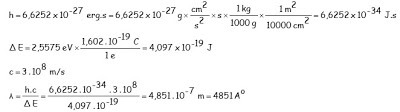En 1913 Niels BOHR adaptó los postulados cuánticos al incipiente modelo atómico de Rutherford. Los puntos fundamentales del nuevo modelo atómico fueron:
1.- El electrón gira alrededor del núcleo. La fuerza centrípeta causante del giro es la fuerza electrostática, PERO EL ELECTRÓN NO EMITE ENERGÍA AL GIRAR. En otras palabras, a cada órbita del electrón le corresponde un nivel de energía estacionario.
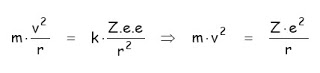
(considerando átomos tipo hidrógeno, es decir con un solo electrón en órbita. El sistema de unidades utilizado es el cgs donde el valor de k es 1)
2.- El segundo postulado supone la cuantización de la energía correspondiente a cada órbita: sólo son posibles las órbitas con ciertos niveles de energía definidos. El desarrollo matemático de este postulado conduce a un nuevo enunciado del mismo:
“sólo son posibles las órbitas donde el producto del momento lineal ( m . v) por la longitud de la órbita (2 π r) sea múltiplo de h ”
Estos dos postulados permiten determinar el radio de las órbitas:
1 ) m.v2.r = Z . e2 2) m.v.2 π r = n.h
Donde n es un número entero llamado número cuántico principal. Elevando el segundo al cuadrado y dividiéndolo por el primero (para eliminar v) se obtiene la expresión:
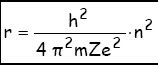
Una vez determinado el radio es posible averiguar también el contenido energético del electrón en órbita (energía cinética + energía potencial eléctrica):
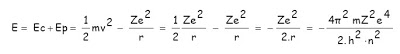
3.- El tercer postulado permite explicar los espectros atómicos. Cuando un electrón pasa de un nivel E2 a otro E1 de menor energía, emite la energía correspondiente a la diferencia de niveles E2 – E1. Esta energía se irradia en forma de onda electromagnética de frecuencia ν, cumpliéndose la hipótesis de Planck:

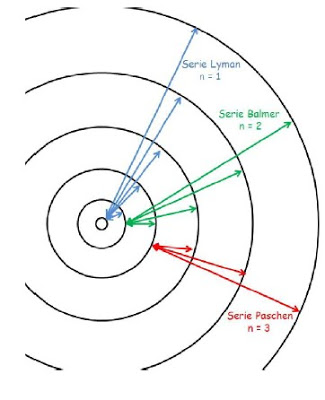
La comparación de esta expresión teórica con la expresión empírica que Balmer obtuvo al estudiar el espectro del átomo de hidrógeno (Z = 1) es evidente. El valor teórico de RH (llamada constante de Rydberg) para el átomo de hidrógeno resulta ser 109740 cm -1 frente al valor empírico de 109677 obtenido por Balmer. Por tanto las líneas espectrales estudiadas por Balmer en el átomo de hidrógeno resultan claras: son transiciones de electrones desde niveles superiores hasta el nivel de número cuántico n igual a 2.
Si el electrón cae desde niveles superiores hasta el nivel de menor energía ( n = 1 ), la radiación emitida tiene mayor energía, mayor frecuencia y queda en la zona ultravioleta (no visible). Estas rayas espectrales descubiertas posteriormente (en 1916) corresponden a la serie de Lyman. De igual manera, si el electrón cae de niveles superiores al nivel de energía n = 3, se tienen radiaciones de menor frecuencia que corresponden a la zona del infrarrojo (no visible) y
constituyen la serie de Paschen.
El modelo atómico de Bohr permitía explicar perfectamente el espectro del átomo de hidrógeno y encajaba perfectamente con las experiencias de Rutherford. Pero los avances técnicos en los
espectroscopios pronto harían ver que era necesario ampliar el modelo de Bohr.
Ejercicio
La energía de los niveles principales de un átomo tipo hidrógeno viene dada por la expresión E = – 13,64 . Z2 / n2 (eV) Calcula la longitud de onda de la radiación emitida por el salto de un electrón desde el nivel n = 4 al n = 2 en un átomo de hidrógeno. DATOS: ( h = 6,6252 . 10-27erg.s e- = 1,602 . 10-19 C )
La expresión permite calcular la energía del electrón en el nivel 4 y el nivel 2:
E4 = – 13,64 . 12 / 42 = – 0,8525 eV E2 = – 13,64 . 12 / 22 = -3,41 eV
La diferencia de energía (E2 – E4 = -2,5575 eV) señala una disminución energética y, de acuerdo a la hipótesis de Planck, supone la emisión de radiación electromagnética formada por fotones de energía 2,5575 eV cuya frecuencia (o longitud de onda) se puede determinar por la expresión ΔE = h.ν = h.c / λ. Por tanto la determinación de la longitud de onda sólo requiere saber expresar los
diferentes datos y valores obtenidos en el sistema internacional de unidades para efectuar los cálculos con corrección: